Quienes Somos
CMC MEDICAL DEVICES & DRUGS, S.L. es una empresa consultora de ámbito internacional, focalizada en asuntos regulatorios de productos sanitarios. Nuestra sede principal en España nos permite operar desde Europa para el resto del mundo, aunque también contamos con representación local en muchos otros países como China, India, Argentina, EEUU, Brazil... Representamos a empresas de todo el mundo, siendo nuestra prioridad la satisfacción de nuestros clientes, y los resultados.
Nuestra misión
Ayudar a nuestros clientes a superar límites y cruzar fronteras
Contribuir a que el mercado de dispositivos médicos más valioso y asequible.
Nuestra visión
Focalizados en las necesidades de nuestros clientes, estudiamos sus necesidades y proporcionamos servicios personalizados con el fin de lograr la mejor solución posible para cada cliente.
Logramos un crecimiento rentable para nuestros clientes mediante la implementación de modelos de negocios diversificados y apertura de mercados.
Crear valor y marcar la diferencia.
Trabajar de manera eficiente y actuar con urgencia.
CMC ofrece a sus clientes soluciones integrales eficaces, flexibles y económicas.
Nuestro Valor
Ser una empresa de confianza para los clientes y la sociedad, una empresa totalmente responsable de sus acciones.
Miembros de:


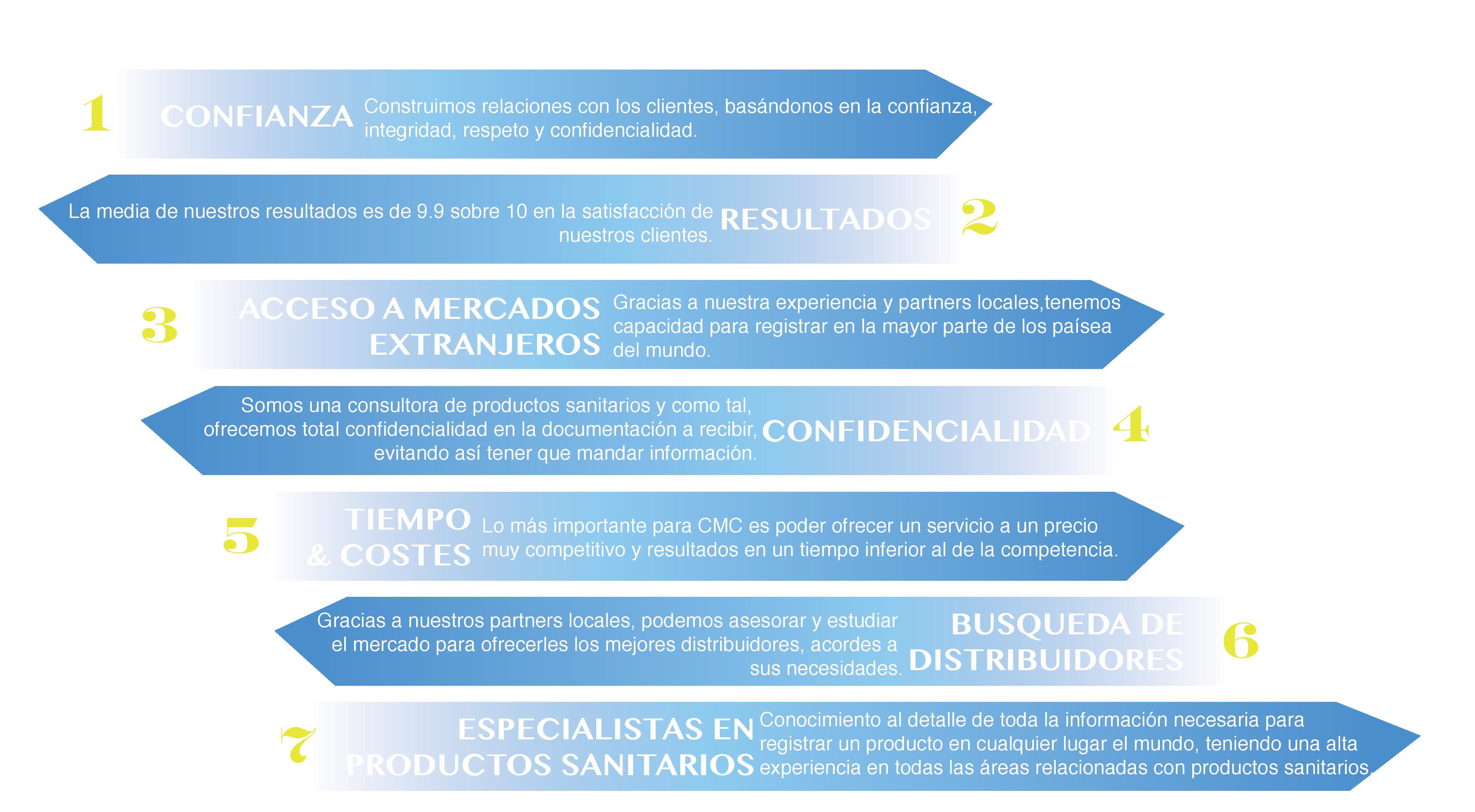
¿Que Nos Diferencia?