关于我们
CMC MEDICAL DEVICES & DRUGS, S.L.是一家专注于监管医疗设备的国际领先咨询公司.公司总部设于西班牙,让我们能更方便的为欧洲乃至于全球各个国家的顾客服务。同时我们也在其他国家开设了分部,比如中国,印度,阿根廷,美国,巴西等。我们全球所有的公司的首要任务和服务宗旨是让每一位顾客满意。
我们的使命
帮助我们的顾客克服跨界服务的各种问题和限制,使医疗器械市场更可用并更有价值。
我们的畅想
专注于客户需求:为每一位客户的最佳解决方案提供定制化的服务。
通过实施开放市场和多元化的经营模式来实现顾客的盈利增长。
为了创造更多价值和改变。
更快,更有效的服务。
CMC为客户提供更全面,更灵活,更有效益的解决方案。
我们的价值
所有的办理流程我们全权负责,只为成为让客户和社会更加信赖的公司。
成员


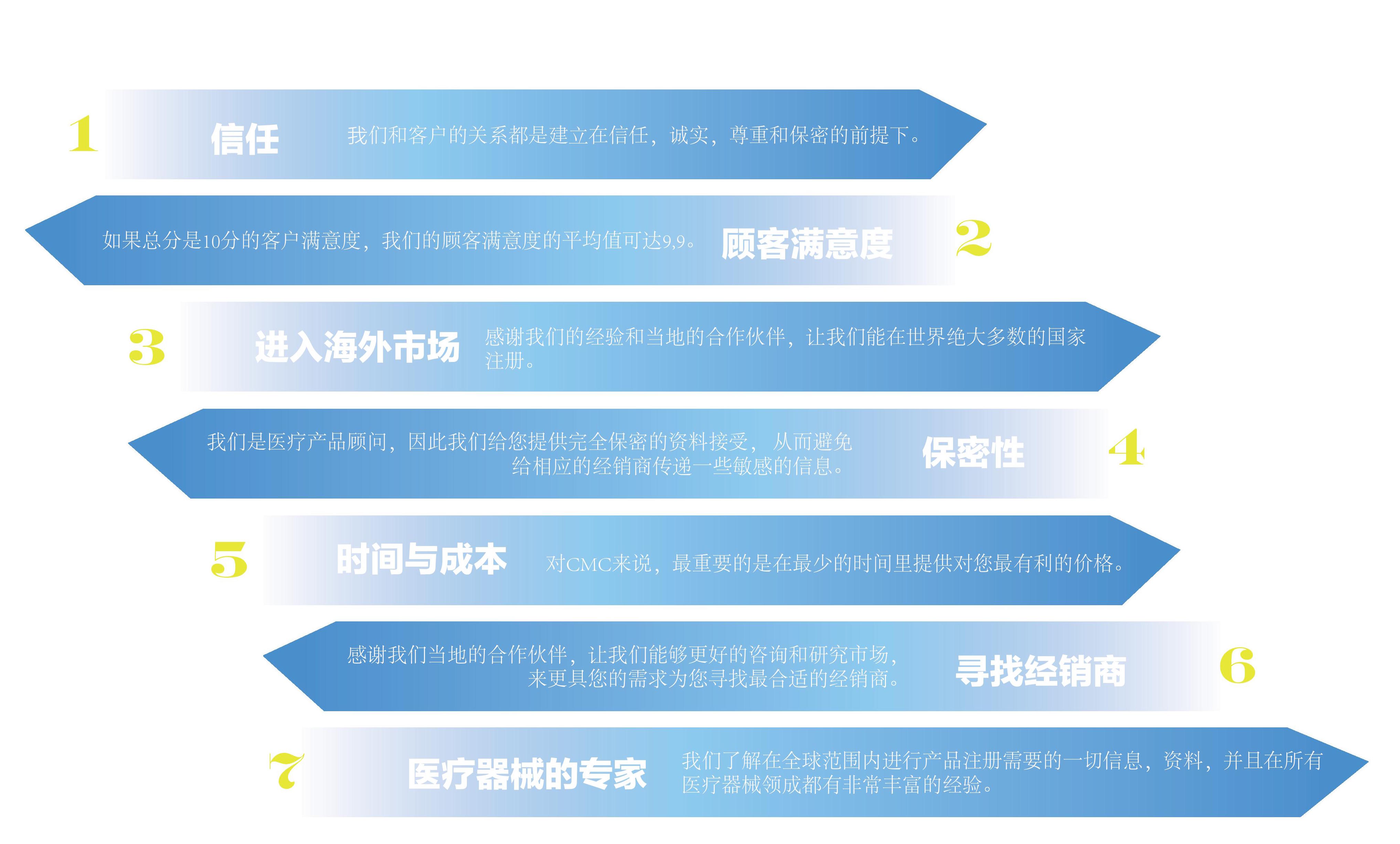
是什么让我们与众不同?